細菌の泳ぎを一瞬で加速する光応答性蛋白質を発見
― 生物共通のシグナル物質を光で操る新技術開発に期待 ―
ポイント
- 遊泳中に光を受けると急加速する土壌細菌を発見した。
- 光を受けて「サイクリックAMP(cAMP)(※1)」を作り出す蛋白質の関与を明らかにした。
- 多種多様な生物が利用するシグナル物質であるcAMPが、細菌べん毛の回転制御にも関わることを明らかにした。
- 光で細胞機能を局部的に制御する光遺伝学の発展が期待される。
【概要】
持続可能な自然エネルギーの代表である太陽光は、視覚や光合成など、生物の機能にとって欠かせない存在です。光を受けて活性化することによりイオン輸送などを行う蛋白質は、光応答性蛋白質と呼ばれ、その遺伝子を神経細胞などに組み込むことで、光によって細胞機能を局部的に操作する光遺伝学という技術が注目されています。
琉球大学医学研究科細菌学講座の許駿助教(研究当時 東北大学大学院生)と東北大学大学院工学研究科の中村修一准教授らの研究グループは、国立感染症研究所、九州工業大学、千葉科学大学、福岡大学と共同で、光を受けた直後に遊泳を急加速する土壌細菌を発見しました。特定した光応答性を担う遺伝子を調べたところ、ヒトを含む多様な生物が細胞応答調節に利用するサイクリックAMP(cAMP)を作り出す酵素の遺伝子でした。光で活性化してcAMPを作る酵素は、真核生物であるミドリムシで初めて見つかりました。原核生物である細菌の運動を一瞬で加速する光活性型cAMP合成酵素の発見は今回が初めてで、新しい光遺伝学ツールの開発につながることが期待されます。
本研究成果は2022年4月27日(日本時間)に英科学誌Scientific Reportsに掲載されました。
詳細な説明
背景
太陽光は代表的な持続可能なエネルギーで、光の性質は工業や医療などあらゆる分野の技術に生かされています。視覚や光合成といった生物の機能においても光は365体育appで、光で活性化してシグナル伝達やイオン輸送を行うロドプシンなど、様々な光応答性蛋白質が研究されてきました。近年では、光応答性蛋白質の遺伝子を神経細胞などに組み込み、局部的な光刺激によって細胞機能を操作する光遺伝学という技術も注目されています。
研究成果
琉球大学医学研究科細菌学講座の許駿助教(研究当時 東北大学大学院生)と東北大学大学院工学研究科の中村修一准教授らの研究グループは、国立感染症研究所の小泉信夫主任研究官、九州工業大学の森本雄祐准教授、福岡大学の尾鶴亮助教、千葉科学大学の増澤俊幸教授(研究当時)と共同で、岐阜県の土壌から分離され、2019年に新種として提唱されたLeptospira kobayashii(レプトスピラ?コバヤシイ)(※2)が、光を受けた直後に遊泳を急加速することを発見しました(図1)。
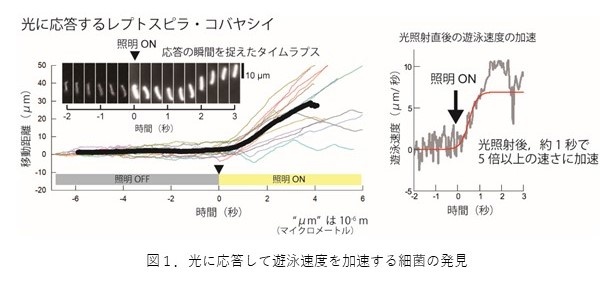
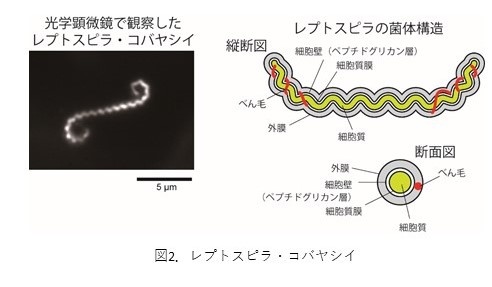
レプトスピラ属は、螺旋形の菌体の内部に2本のべん毛(※3)を持つ運動性細菌のグループです(図2)。16S リボソームRNA(rRNA)遺伝子の塩基配列(※4)に基づく分類によって、S1とS2という2つの非病原性クレード(※5)と、P1とP2という2つの病原性クレードに分けられますが、本研究により国内で発見?分離されたレプトスピラ属株のうち、レプトスピラ?コバヤシイと同じS2クレードに分類される株は全てが光応答性を示すことが明らかとなりました。
光応答性遺伝子の特定
光応答性を担う遺伝子を特定するため、ゲノム全体を対象とした網羅的遺伝子探索を行いました。まずゲノム中に薬剤耐性遺伝子をランダムに挿入し、約2,400 株の変異体を作製し、光応答性の有無を調べました。もし偶然に、光応答性遺伝子に薬剤耐性遺伝子が挿入されている(光応答性遺伝子が薬剤耐性遺伝子で分断、破壊されている)場合、その変異体は光応答性蛋白質を作ることができないため、光が照射されても運動に変化が表れません。得られた変異体の光応答性を1株ずつ顕微鏡で確認した結果、期待通りに光応答性が欠損した変異体が見つかり、薬剤耐性遺伝子の挿入位置から、光応答性を担う遺伝子を特定することに成功しました。私たちは、この遺伝子をlprA(leptospiral photoresponsive protein A)遺伝子と名付けました。
光刺激依存的なcAMP合成の確認
lprA遺伝子は、光センサーと思われる部分と細胞内のシグナル伝達物質であるサイクリックAMP(cAMP)を合成する酵素(アデニル酸シクラーゼ)の部分から構成されています。lprA遺伝子が光依存的なcAMP合成に関わることを確かめるため、レプトスピラ?コバヤシイでのcAMP合成測定を試みましたが、測定限界に近い極低濃度であることが分かりました。そこで、コドン最適化(※6)によって、lprA遺伝子を大腸菌で過剰発現させることに成功し、大腸菌の中でlprA遺伝子から作られた蛋白質(遺伝子と区別して“LprA”と表記)による光依存的なcAMP合成を確認することができました(図3)。
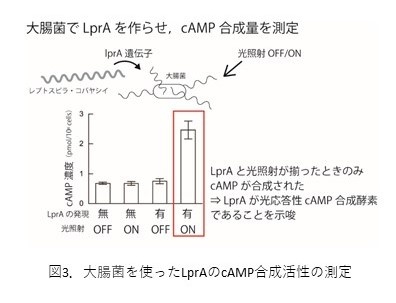
光応答性酵素はべん毛モーター近くに局在
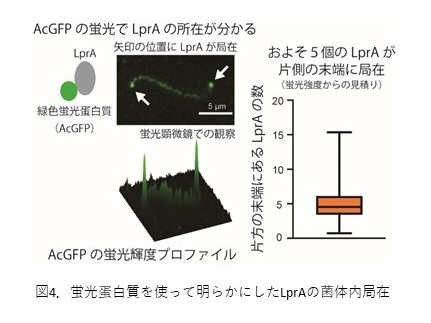
緑色蛍光蛋白質を標識してレプトスピラ?コバヤシイの菌体内でのLprAの局在を調べたところ、発現量は少ないものの、興味深いことにべん毛が存在する菌体両末端にLprAが局在していることが明らかとなりました(図4)。運動器官であるべん毛の近くにLprAが集まることでcAMP濃度も局所的に高まる信号増幅の効果が誘発され、その結果、光照射後すぐに応答できるのではないかと考えています。
意義
光活性型アデニル酸シクラーゼはミドリムシで初めて発見され、光合成細菌でも類似遺伝子が見つかっています。cAMPが遺伝子発現を介して微生物運動に関わることは知られていますが、レプトスピラ?コバヤシイのように秒単位で光に応答して運動パターンを変化させる例はこれまでにありません。べん毛を利用した運動は細菌の生存や病原性に関わることから、世界中の研究者が精力的に研究しており、べん毛回転を制御する様々な因子が調べられていますが、cAMPがべん毛回転を制御することを示したのは本研究が初めてです。さらに、レプトスピラ属以外にも、多くの微生物種がlprA遺伝子の相同遺伝子を持っていることも分かりました。LprAが関わるシグナル伝達には未だ明らかでない部分がありますが、本研究の成果は、新しい細胞内シグナル経路の発見につながることが期待されます。cAMPは蛋白質のリン酸化に関わるなど、細胞機能に欠かせないシグナル媒介物質です。新しい光活性型cAMP合成酵素の発見は、光遺伝学の新材料開発につながることが期待されます。
本研究は、科学研究費補助金?新学術領域「運動超分子マシナリーが織りなす調和と多様性」(15H01307)、新学術領域「情報物理学でひもとく生命の秩序と設計原理」(20H05524)、基盤研究(B)(21H02727)、基盤研究(C)(19K07571、21K06099)、特別研究員奨励費(18J10834)、学術変革領域研究(A)(21H05532)、科学技術振興機構?戦略的創造研究推進事業?さきがけ(JPMJPR204B)の助成により行われました。
【用語説明】
※1 サイクリックAMP(cAMP)
ヒトからバクテリアまでの幅広い生物種でシグナルとして働く分子である。細胞内シグナル伝達でセカンドメッセンジャーとして働き、遺伝子調節など多くの生体機能の調節を担っている。
※2 Leptospira kobayashii(レプトスピラ?コバヤシイ)
本研究の共同研究者である増澤俊幸教授らによって分離された非病原性のレプトスピラ種。種名は、レプトスピラの分類にモノクローナル抗体を導入したことで知られる小林譲博士に因んで命名された。
※3 べん毛
細菌の運動器官。直径約20ナノメートルの細長い螺旋繊維の根元に直径約50ナノメートルの回転モーター(べん毛モーター)があり、水素イオンやナトリウムイオンを利用して回転する。大腸菌やサルモネラなどは菌体の外側にべん毛が伸びているが、レプトスピラが属するスピロヘータ目の細菌は、外膜と細胞壁の間にべん毛が存在する。ミドリムシなど真核生物の鞭毛とは構造も動作機構も異なるため、日本語では「細菌“べん”毛」と平仮名で書くことで真核生物の「“鞭”毛」と区別する。
※4 16S rRNA遺伝子の塩基配列
遺伝子の情報に従ってアミノ酸を重合させる反応を担うリボソームに含まれるRNA(リボ核酸)の1つ。ほとんどの微生物が持ち、塩基配列の保存性が高いため、微生物の分類の指標に用いられる。
※5 クレード
共通の祖先から分岐した系統グループ。
※6 コドン最適化
遺伝子の情報(塩基配列)をアミノ酸配列に変換(翻訳)する際、1つのアミノ酸に対して3つの塩基配列が対応付けられている。この1組3塩基の配列をコドンと呼ぶ。1種類のアミノ酸に複数のコドンが対応しており、種によって使われるコドンに偏り(バイアス)がある。例えば、コドンバイアスの異なる生物Aと生物Bがあり、生物A由来の遺伝子を生物Bで発現させようとする場合、アミノ酸配列を変えずに、各アミノ酸のコドンが生物Bで利用頻度の高いコドンに置き換わるよう塩基配列を改変(Bに最適化)する必要がある。この改変作業をコドン最適化という。
■ 発表雑誌
| 論文タイトル | “Light dependent synthesis of a nucleotide second messenger controls the motility of a spirochete bacterium” |
| 著者 | Xu J., Koizumi N., Morimoto Y.V., Ozuru R., Masuzawa T., Nakamura S. |
| 雑誌名 | Scientific Reports |
| DOI | 10.1038/s41598-022-10556-7 |
| URL | https://www.nature.com/articles/s41598-022-10556-7 |
【研究内容に関するお問い合わせ】
東北大学大学院工学研究科応用物理学専攻
准教授 中村 修一
TEL: 022-795-5849
E-mail: shuichi.nakamura.e8*tohoku.ac.jp
九州工業大学大学院情報工学研究院物理情報工学研究系
准教授 森本 雄祐
TEL: 0948-29-7833
E-mail: yvm001*phys.kyutech.ac.jp
福岡大学医学部微生物?免疫学講座
助教 尾鶴 亮
TEL:092-801-1011(代)
E-mail: ozuru*fukuoka-u.ac.jp
【取材報道に関するお問い合わせ】
東北大学大学院工学研究科情報広報室
担当 沼澤 みどり
TEL: 022-795-5898
E-mail: eng-pr*grp.tohoku.ac.jp
九州工業大学広報課広報係
TEL: 093-884-3007
E-mail: sou-kouhou*jimu.kyutech.ac.jp
琉球大学上原キャンパス事務部企画課企画係
TEL: 098-895-1541
E-mail: kkikaku*acs.u-ryukyu.ac.jp
福岡大学企画総務部広報課
TEL:092-871-6631(代)
E-mail: fupr*adm.fukuoka-u.ac.jp
(メールは*を@に変えてお送りください)